脓毒症是指由感染导致的全身炎症反应综合征,常引起全身性多器官衰竭而最终致使患者死亡。脓毒症发生率高,病情进展迅速,病死率已经超过心肌梗死,成为重症监护病房内非心脏病人死亡的主要原因。
近年来,尽管抗感染治疗和器官功能支持技术取得了长足的进步,但由于脓毒症的根本发病机制尚未明了,涉及到多系统、多器官病理改变进程,缺乏明确的治疗靶点,临床上尚无特效疗法。随着科研工作者对脓毒症以及间充质干细胞研究的持续深入,他们发现间充质干细胞外泌体中携带的微小RNA(miRNAs)对脓毒症病理进程的发展有重要影响。另有研究指出,miR-27b在间充质干细胞外泌体中的含量尤其丰富,可能与脓毒症的病理进程发展密切相关,但miR-27b的具体作用以及治疗脓毒症的机理并不清楚。
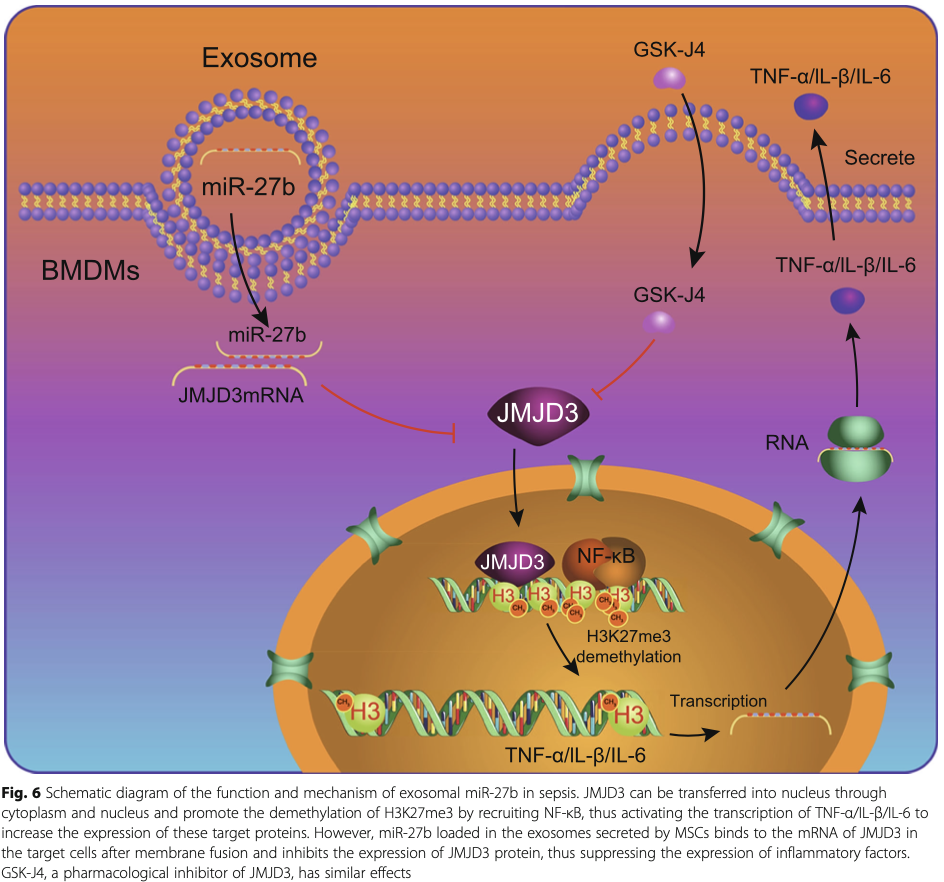
日前,《Stem Cell research&Therapy》发表一篇论文,刊载了Dr.Qiu团队在间充质干细胞治疗领域的最新研究进展:间充质干细胞外泌体中所含的miR-27b能够通过抑制JMJD3以及NF-κB/p65,进而抑制炎症反应并阻碍脓毒症的病理进程。通过明确miR-27b/JMJD3/ NF-κB/p65信号轴以及其功能可以为脓毒症的治疗和预防提供新的策略。

间充质干细胞外泌体中miR-27b的积极作用及作用机理:
1.间充质干细胞外泌体中miR-27b的含量较成纤维细胞外泌体高。研究团队首先在体外培养小鼠骨髓来源的间充质干细胞并分离出骨髓间充质干细胞来源的外泌体(MSC-EXO),并通过与小鼠皮肤成纤维细胞来源的外泌体比较,利用qPCR等手段进行成分分析后发现,间充质干细胞外泌体中miR-27b含量较成纤维细胞外泌体更高。
2.注射了MSC-EXO的模型小鼠生存率更高。首先,研究人员使用盲肠结扎穿刺法构建了小鼠脓毒症模型,并向小鼠骨髓间充质细胞中转入miR-27b抑制剂,制备得到miR-27b含量敲低的外泌体(miR-27-knockdown-MSC-EXO)。然后,分别向小鼠脓毒症模型动物注射MSC-EXO和miR-27-knockdown-MSC-EXO。最终发现注射了MSC-EXO的模型小鼠相较于注射miR-27-knockdown-MSC-EXO的小鼠有较高的7日生存率。
3.给与MSC-EXO注射的小鼠体内TNF-α、IL-1β以及IL-6的水平均有下降,而IL-10的水平则升高。
4.接受MSC-EXO注射的小鼠组织器官损伤评分较低。研究人员取实验小鼠的肝、肾、肺组织切片进行HE染色并进行损伤评分,数据显示接受MSC-EXO注射的小鼠的组织器官具有较低的损伤评分,而接受敲低miR-27b间充质干细胞外泌体注射的小鼠器官损伤评分则较高。
结合多项数据,研究团队认为小鼠骨髓间充质干细胞外泌体中的miR-27b在小鼠脓毒症模型中具有抑制脓毒症发展,改善模型动物生存率的作用。此外,该团队又进一步通过生物信息学、大数据分析以及细胞实验验证的手段进行探究,深入解析了miR-27b对脓毒症的作用机理以及信号通路。这一发现或成为一种有效的工具帮助科学家们更快地开发出针对脓毒症的特效疗法。
间充质干细胞:治疗脓毒症的新突破口
从近年来多项文献报道中,我们已经看到了间充质干细胞治疗脓毒症的应用潜力。阿姆斯特丹大学的一项人体试验证实,人类也可以同样受益。研究人员通过种种实验表明,静脉输注同种异体间充质干细胞在人内毒素血症中具有多种促炎、抗炎和促凝血作用。这一研究成果也充分显示了干细胞在脓毒症治疗方面的应用前景。
干细胞治疗脓毒症,主要依靠干细胞分泌的外泌体。而外泌体成分多样,作用机制复杂,很长时间研究人员都无法证实外泌体中的哪些成分在脓毒症的治疗中发挥着作用。Dr.Hu团队的这一研究证实,在治疗中发挥积极作用的是间充质干细胞外泌体中的miR-27b,并明确了miR-27b的作用机制。可以说,这一发现,为干细胞治疗脓毒症提供了理论基础,也为未来探究更完备的特效疗法提供了新的思路。
间充质干细胞新疗法,指日可待
国内外已发表的研究结果显示,间充质干细胞有很大的潜力来改善脓毒症患者的症状和生活质量。未来,随着更加全面、大规模的临床试验的开展,治疗脓毒症的临床应用也将离人们不再遥远。届时,应运而生的间充质干细胞新疗法,也将让更多的患者受益。